腸内細菌叢の領域では、Akkermansia muciniphila (略してAkk細菌) は「スタープロバイオティクス」として長い間祝われてきました。 しかし、Nature Microbiologyに掲載された清華大学の研究チームによる最近の研究では、このいわゆる「腸の保護者」に驚くべき「役割の逆転」をもたらしました-特定の免疫条件下で、一見無害に見えるAkk細菌が病原体の共犯者に変わる可能性があることを明らかにしました、腸感染症の拡大をひそかに悪化させる。 この「二重スパイ」ドラマは微生物の世界でどのように展開されますか?

Akkermansia muciniphila (略して「Akk bacteria」) という名前は、すでにその独自の生存戦略を示唆しています。この「ムチンを愛する」微生物は、主にムチンに依存しています。その食物源としての腸粘液層の主成分。 腸の破壊者であるどころか、この「粘液を食べる人」は専用の腸の世話人として機能し、消化器の健康を維持する上で複数の重要な役割を果たします。
ムチンを分解することにより、Akk細菌は腸上皮細胞を継続的に刺激して修復し、より多くの粘液を分泌します。最適な腸粘膜バリア (有害な侵入者から腸を保護する保護層) を積極的に再構築および維持します。
ムチンを代謝することにより、腸細胞の直接エネルギー源として機能する短鎖脂肪酸である酪酸などの有益な副産物を生成します。 これらの代謝物はまた、体のエネルギー代謝を調節するのに役立ち、腸の健康を全体的な代謝効率に結び付けます。
Akk菌は免疫細胞と直接通信し、炎症反応の強度を微調整します。 この相互作用により、腸の局所免疫系の微妙な平衡が確保され、過度の炎症と免疫怠慢の両方が防止されます。
物理的な粘液バリアを強化することにより、Akk細菌は、毒素や病原体が腸の内壁に浸透して血流に入るのを防ぐ強力なシールドを作成し、腸の最初の防御線を強化します。
この多機能の役割-粘液層に栄養を与え、腸を修復し、免疫を調節し、代謝をサポートする-「スタープロバイオティクス」および腸の健康の象徴的なシンボルとしてのAkk細菌の長年の地位を固めました。
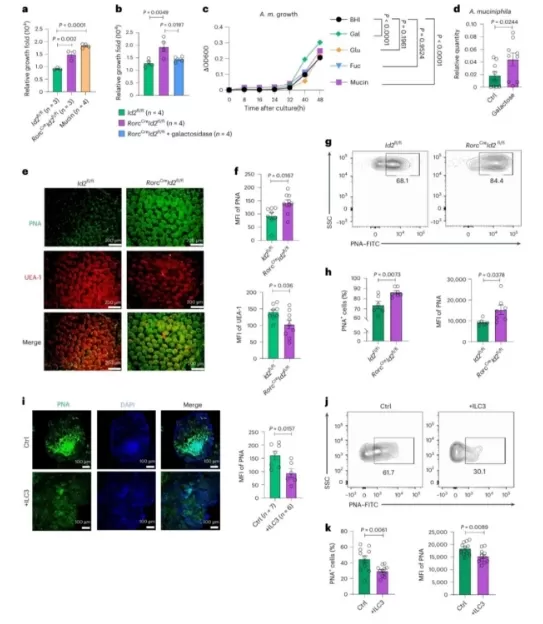
研究者がILC3免疫細胞を欠くモデルで異常に重度の腸感染症を観察したとき、物語は劇的に変わりました-Akk細菌の隠された暗い側面を明らかにしたパラドックス。
健康な腸では、ILC3免疫細胞は「腸のパトロールガード」として機能し、IL-22のサイトカインを継続的に分泌します。 この分子は、腸上皮細胞の保護コーティングのように機能し、2つの重要な機能を実行します。
・A。 物理的な障壁の強化: フコシル化を増やすことにより、病原菌が腸の内壁に付着するのを直接ブロックする滑らかな粘膜表面を作成します。
・B。 代謝制御: ガラクトシル化レベルを正確に調節し、過剰なAkk細菌の増殖に利用できる炭素源を制限し、個体数を抑制します。
ILC3セルがないと、この微調整されたシステムが崩壊し、危険なカスケードが引き起こされます。
1.制御されていない増殖: 腸細胞のガラクトシル化が急増し、Akk細菌に栄養素の「無制限のビュッフェ」を提供します。 これにより、人口は指数関数的に爆発します。
2.有毒な代謝物の生成: 生い茂ったAkk菌は、高レベルで有害になる短鎖脂肪酸であるコハク酸で腸を氾濫させ始めます。
・A。 微小環境の変化: 腸のpHを低下させ、Citrobacter rodentiumのような病原体がコロニーを形成して増殖するための理想的な環境を作り出します。
・B。 病原体活性化: コハク酸は、病原性因子Tir (アドヘシン) やLer (病原性島調節因子) などの病原性遺伝子を直接オンにします。 これにより、腸細胞に付着して毒素を分泌する病原菌の能力が高まります。
この「善意g1つの間違った「連鎖反応は、Akk細菌を腸保護者から病原体のサイレント共犯者に変換し、感染の重症度とリスクを指数関数的に増幅します。
この研究は、宿主の免疫系と腸内細菌叢の間の動的平衡を支配する複雑なメカニズムを初めて明らかにします。これは、細菌が味方または敵として機能するかどうかを決定する繊細なダンスです。
ILC3免疫細胞 → 分泌性IL-22サイトカイン → 腸細胞ガラクトシル化を阻害 → 過剰なAkk菌の増殖を制限 → 粘膜層の安定性を維持
ILC3欠乏症 → 不十分なIL-22 → 制御されていないガラクトシル化 → 爆発的なAkk菌の増殖 → 過剰なコハク酸分泌 → 強化された病原体病原性
この発見は、「プロバイオティクスは普遍的に有益である」という従来の信念を打ち砕き、微生物の役割は完全に宿主の免疫コンテキストに依存していることを証明しています。 生態系の種のように、単一の細菌株の規制されていない優位性 (「有益な」ものでさえ) は、鱗を傾け、腸の全体的な恒常性を混乱させる可能性があります。
ILC3は、ガッツグリコシル化を調節してAkk細菌の増殖を制限します
この研究は、Akk細菌のプロバイオティクスの可能性を損なうものではありませんが、重要なリマインダーとして役立ちます。真の腸の健康は、微生物の同盟国の文脈に依存する性質を理解することにあります。 腸の健康を管理するための意味は次のとおりです。
保護サイトカインを産生ILC3-whichような免疫細胞の正常な機能を維持することは、単にプロバイオティクスを補給するよりも重要であるIL-22-may性があります。 強力な免疫系は腸内細菌叢の「導体」として機能し、Akkのような有益な細菌が有害な状態に移行するのではなく、保護的な役割を維持することを保証します。
腸内細菌は真空中では機能しません。その影響は、独自の免疫環境によって異なります。 マイクロバイオームプロファイリングと一緒に免疫マーカー (IL-22レベルなど) を定期的に評価すると、介入を調整するのに役立つ可能性があります。免疫機能障害のある人には、1人の腸の健康を高めるものが裏目に出る可能性があります。
腸の健康は、免疫細胞、腸上皮細胞、および微生物叢の間の三者間の協力です。 ILC3活性の低下、粘膜バリアの弱体化、またはチェックされていない細菌の異常増殖など、あらゆるコンポーネントの混乱が連鎖的な問題を引き起こす可能性があります。 この繊細な生態系を育むには、単一の微生物を標的にするだけでなく、全体論的なアプローチが必要です。
Akkバクテリアである「二重性格のプロバイオティクス」を再考すると、教訓は明らかです。真の腸の健康は、この内部生態系の複雑さを尊重することから始まります。 「万能」ソリューションを追いかける代わりに、免疫回復力 (微生物の相互作用を調節する体自身の能力) を優先することは、私たちの細胞とその微生物パートナーとの間の調和のとれた共存を促進するための鍵かもしれません。
腸内細菌叢は免疫系とどのように会話しますか?プロのナチュラルフィールドに従う免疫サポート成分メーカー、最新の最先端の腸の健康研究のために、人間のマイクロバイオームの謎を解明するために私たちに参加してください!