人間の腸内細菌による複雑な炭水化物や他の高分子の分解は、隣接する微生物が嫌気性呼吸に利用する代謝物を生成します。 しかし、腸内の他の食物化合物の交差摂食がエネルギーを生み出すレドックス反応を促進できるかどうかは依然として不明です。
2025年8月4日、イェール大学の研究者は、「食事性抗酸化物質の代謝的交差摂食は、ヒトの腸内細菌による嫌気性エネルギー代謝を高める」というタイトルの研究をCellHost & Microbeで発表しました。cellのサブジャーナル。
この研究は、食事性抗酸化剤エルゴチオネインの代謝交差摂食が人間の腸内細菌の嫌気性エネルギー代謝を促進することを明らかにしました。

この画期的な研究で、研究チームは、異なる門からの腸内細菌が嫌気性条件下で一般的な食事の抗酸化物質を交換してエネルギーを生成することを実証しました。 共生細菌のクロストリジウムシンビオサムは、エルゴチオネイン (キノコ由来の抗酸化剤) を電子受容体のチオウロカニン酸 (TUA) に変換するエルゴチオネナーゼ酵素をコードしています。 その後、キシラン分解細菌のキシラニソルベンはTUAを還元し、ATP合成を大幅に強化し、細菌の増殖を促進します。 さらに、TUAは、特定のヒト糞便微生物群集によって選択的に生成および消費されます。
腸エルゴチオネインホメオスタシスと結腸直腸癌との間に新たに発見された関連性と一致して、エルゴチオネナーゼ遺伝子は、結腸直腸癌患者の糞便中のメタゲノムが有意に豊富であることがわかりました。
これらの集合的な発見は、共生抗酸化栄養素のクロスフィードが微生物のエネルギー代謝をどのように強化するかを明らかにし、病気のリスクの個人間の違いを説明する可能性があります。 具体的には:
C. symbiosumのエルゴチオネナーゼは、食事中のエルゴチオネインをTUAに変換します。
B.キシラニソルベンはTUAを電子受容体として利用し、対照と比較してATP生成を2.3倍促進します。
TUAダイナミクスは、ヒト微生物叢全体で選択的な生産/消費パターンを示します。
特に、エルゴチオネイン-TUA代謝軸はCRC患者で特に活発であり、エルゴチオネイナーゼ遺伝子の存在量は疾患の進行と相関していました (p<0.01)。 このレドックスベースのクロスフィードメカニズムは、食事の抗酸化物質、腸内微生物の生態学、および癌の感受性の間の新しいリンクを表す可能性があります。
Clostridium symbiosumは、エルゴチオネイン (EGT) をチオウロカニン酸 (TUA) に代謝します。
TUAは、その嫌気性成長とATP合成を強化するために、バクテロイドキシラニソルベンによって利用できます。
人間の糞便微生物群集は、代謝交差摂食を通じてEGTを還元TUAに変換することができます。
TUA産生の原因となる遺伝子は、結腸直腸癌患者の糞便中に豊富に含まれています。
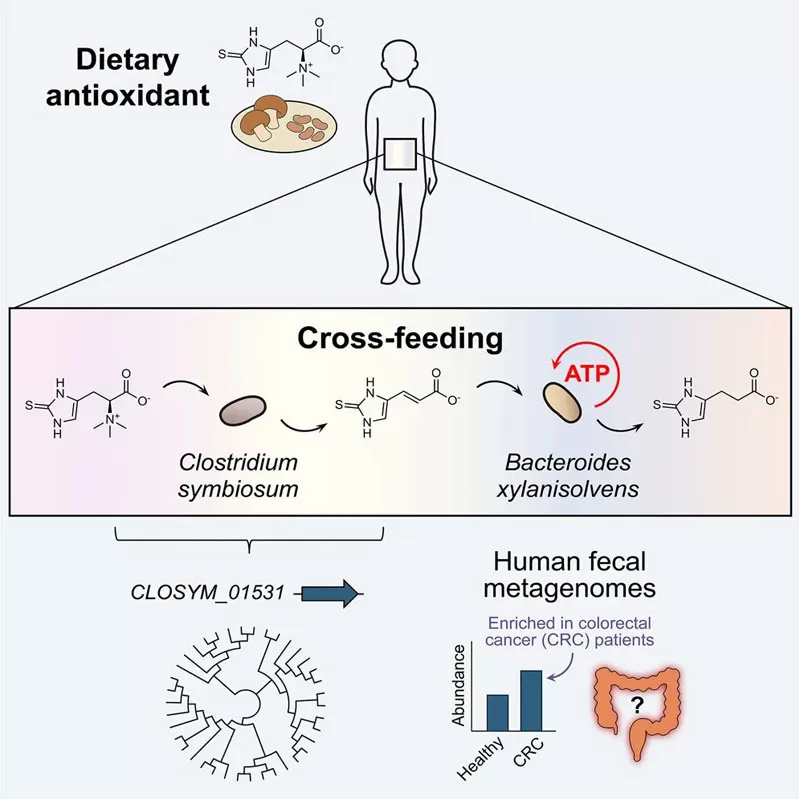
まとめると、これらの結果は、抗酸化栄養素の共生的交差摂食が微生物のエネルギー代謝を高めることを示しています。これは、病気のリスク感受性の個人間の変動を説明する可能性のあるメカニズムです。
ペーパーリンク: https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(25)00280-X